Коллоквиум 6.
1.
Гормоны - гликопротеины: ЛГ, ФСГ, ТТГ. Место образования – гипофиз.
Действуют на 7-TMS рецепторы ® G-белок ® ФЛ С ® расщепляет
фосфатидилинозитол на ИФ3 или ДАГ или 7-TMS-рецепторы ® G-белок ® активация аденилатциклазы ® цАМФ ® Протеинкиназа А ® фосфорилирование белков.
2. Гормоны
– простые белки:
а) пептиды
(< 20 АК): окситоцин, вазопрессин, тиреотропин- и гонадотропинрилизинг
гормоны, соматостатин – гипоталамус
б)
белки (> 20 АК): кортикотропин- и соматотропинрилизинг гормоны – гипоталамус,
пролактин, СТГ, АКТГ – передняя доля гипофиза, инсулин, глюкагон – островки
поджелудочной железы, холецистокинин, панкреозимин – энтероэндокринная система,
паратирин – паращитовидная железа, кальцитонин – С-кл щитовидной железы.
Пример
действия простого белка: вазопрессин + 7-TMS рецептор ® Gq-белок ® ФЛ С ® ДАГ + ИФ3 ® Ca2+® 1) вазоконстрикция 2) усиливает реабсорбцию
воды в нефроне.
3. Гормоны
– производные АК: мелатонин – эпифиз, катехоламины (А, НА, дофамин) –
нейроны и мозговое вещество надпочечников, Т3 и Т4 (тироксин) – щитовидная
железа.
Т3
+ ядерный рецептор (есть цинковые пальцы, но нет HSP) ® димеризация рецептора Т3 с рецептором
ретиноевой кислоты ® активный гетеродимер ® связь с промотором ДНК ® активация транскрипции.
4. Особенности биологического действия
гормонов:
1)
находятся в очень низкой концентрации в крови (10-
2)
обязательна связь с рецептором, включающая каскадный механизм и усиление
гормонального сигнала (на поверхности клетки, в цитоплазме или ядре)
3)
изменение скорости синтеза ферментов и их активности
4)
регуляция секреции по принципу прямой или обратной связи
5. Классификация рецепторов:
1.
Мембранные рецепторы
а)
7-TMS рецепторы, взаимодействующие с гетеротримерными G-белками
б)
1-TMS рецепторы со свойствами гуанилатциклазы, тирозинкиназы,
протеинфосфатаз, сер/тре протеинкиназ, взаимодействующие
с тирозинкиназой.
в)
ионные каналы (лиганд-зависимые, потенциал-зависимые, щелевые контакты)
2.
Ядерные (со свойствами регуляторов транскрипции) и цитозольные рецепторы.
Функциональное
назначение G-белка: 1) Gsa – активация АЦ, 2) Gia – ингибируют АЦ, 3) Gqa – реагируют с ФЛ С и активируют ее 4) Goa – открывают Ca2+-каналы.
6. Вторичные
посредники в проведении гормонального сигнала в клетку: а) циклические
мононуклеотиды (цАМФ, цГМФ) б) ИФ3 в) ДАГ г) другие липиды д)
цитозольный Ca2+ е) оксид азота.
7. Механизмы образования и роль вторичных
посредников в механизме действия гормонов:
1)
Г + 1-TMS рецептор ® Å гуанилатциклазу ® цГМФ ® активация цГМФ-зависимой протеинкиназы G ® фосфорилирование остатков
серина и треонина в белках-мишенях.
2)
Г + 7-TMS рецептор ®Gs- или Gi-белок
® Å АЦ или Æ АЦ ® цАМФ или ¯ цАМФ. цАМФ ® активация протеинкиназы А ® фосфорилирование белков-мишеней.
3)
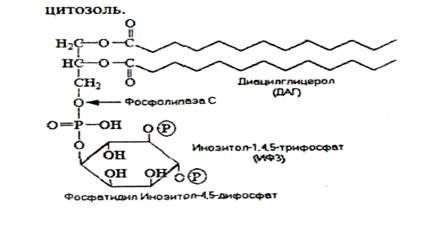
Г + 7-ТМS рецептор ® Gq-белок ® активация ФЛ С ® расщепление фосфатидилинозитола на ДАГ и ИФ3.
ДАГ ® активация протеинкиназы С ® фосфорилирование белков-мишеней. ИФ3
® открытие
Ca2+-каналов ® Ca2+ ® непосредственные эффекты (участие в
сокращении и т.п.) или в комплексе к белками (кальмодулином)
4)
Г + 7-TMS рецептор ® Goa ® открытие Ca2+-каналов ® Ca2+.
8. Механизм передачи гормонального сигнала к
фосфолипазе С:
Г +
7-TMS рецептор ® Gq-белок ® активация ФЛ С ® расщепление фосфатидилинозитола на ДАГ и ИФ3.
ДАГ ® активация протеинкиназы С ® фосфорилирование белков-мишеней. ИФ3
® открытие
Ca2+-каналов ® Ca2+ ® непосредственные эффекты (участие в
сокращении и т.п.) или в комплексе с белками (кальмодулином).
|
|
9. Роль ионов Ca2+: 1) являются вторичными
посредниками, участвуя в амплификации первичного сигнала (гормона). 2) могут
оказывать прямое активирующее действие (активация протеинкиназы С) или
опосредованное через специальные Ca2+-связывающие белки
(кальмодулин). Комплекс Ca2+-кальмодулин активирует ряд
ферментов (аденилатциклазу).
10.
Активация мембранносвязанной гуанилатциклазы: атриопептид, пептиды,
секретируемые яичником, эндотоксин бактерий + 1-TMS рецептор ® изменение конформации передается на
подмембранный домен (мембранносвязанную гуанилатциклазу) ® измененине ее конформации ® активация гуанилатциклазы ® из ГТФ образуется цГМФ ® активация фосфодиэстеразы ® из цАМФ образуется АМФ.
Активация
растворимой гуанилатциклазы: NO(образуется из аргинина с
помощью оксигеназных реакций) + растворимая гуанилатциклаза ® активация гуанилатциклазы (за счет изменения
структуры гема, входящего в состав гуанилатциклазы) ® образование цГМФ из ГТФ ® активация протеинкиназы G ® а) дефосфорилирование
белков легких цепей миозина ® расслабление ГМК сосудов ® вазодилятация или б) фосфорилирование СЕР
или ТРЕ.
11.
Механизм усиления – амплификация –
активация одним ферментом других ферментов и увеличение числа вовлекаемых
молекул в геометрической прогрессии в ферментных каскадах.
12.
Общие принцип синтеза гормонов пептидной природы: синтез препрогормона
на грЭПС по механизму матричного синтеза ® удаление сигнального
пептида и превращение препрогормона в прогормон ® транспорт прогормона в КГ ® удаление дополнительных пептидов прогормона
и образование гормона ® упаковка в секреторные
гранулы для последующей секреции.
13.
Гормоны гипоталамуса белково-пептидной природы. В зависимости от того,
вызывают освобождение гормонов гипофиза
или угнетают их выделение называются
либеринами или статинами. Семь либеринов: кортиколиберин, тиролиберин, люлиберин, фоллиберин, соматолиберин, пролактолиберин, меланолиберин
и три статина: пролактостатин, меланостатин, соматостатин. Регуляция по принципу обратной
связи (в основном) или прямой (взаимовлияние ЛГ и эстрогена).
15.
Место образования вазопрессина и окситоцина: нейроны гипоталамуса, затем
транспортируются в заднюю долю гипофиза в комплексе с белками-нейрофизинами I, II и III. По
химической природе пептиды с дисульфидной связью. Механизм действия:
окситоцин + 7-TMS рецептор ® Gq-белок ® ФЛ С ® ДАГ + ИФ3 ® Ca2+® 1) Å выделения молока 2) Å сокращения матки 3) Å перистальтики семявыносящих
канальцев.
Вазопрессин: вазопрессин + 7-TMS
рецептор ® Gq-белок ® ФЛ С ® ДАГ + ИФ3 ® Ca2+® 1) вазоконстрикция 2) усиливает реабсорбцию
воды в нефроне.
16.
Путь передачи гормонального сигнала от рецептора гормона роста: СТГ + 1-TMS
рецептор ® димеризация р-ра ® гомодимер + JAK-белки (обладают
тирозинкиназной активностью)®:
а) JAK-2-киназа
® STAT-белки (переносчики сигнала
и активаторы транскрипции) ® связь с промотором ® активация транскрипции
б)
активация IGF (инсулиноподобный фактор роста-I).
Основные
эффекты СТГ:
Å рост костей, хрящей, мышц,
синтез белков, НК, Å липолиз, Å глюконеогенез, лактогенная
активность, уровень гл в плазме.
17.
Гормоны щитовидной железы:
1)
производные АК а) T3 (3,5,3’-трийод-L-тиронин) б) Т4
(3,5,3’,5’-тетрайод-L-тиронин или тироксин)
2)
пептид - кальцитонин
Т3
+ ядерный рецептор (есть цинковые пальцы, но нет HSP) ® димеризация рецептора Т3 с рецептором
ретиноевой кислоты ® активный гетеродимер ® связь с промотором ДНК ® активация транскрипции.
Основные
эффекты Т3 и Т4:
1)
влияет на нормальное развитие плода 2) Å синтез белков (в первую
очередь энергетического обмена) 3) Å потребление О2 и
теплопродукцию за счет увеличения Na+/К+-АТФазы во
всех тканях, кроме мозга, селезенки, яичек 4) синтез эритропоэтина и
содержание 2,3-ДФГ в эритроцитах 5) усиливает основной обмен 6) ¯ активность
супероксиддисмуттаза 7) глюконеогенез, усвоение гл,
гликогенез, липолиз, ¯ гликогенолиз 8) число рецепторов к ЛПНП 9) сердце: транскрипцию легкой цепи миозина, Å Ca2+-АТФазу, число β-Ар 10) стимулирует дыхательный
центр 11) повышение моторики ЖКТ 12) повышает резорбцию костей.
Основные
эффекты кальцитонина: ¯ резорбции Ca2+ и РО43- из костей, ¯ реабсорбцию Ca2+ и РО43- в почках.
18.
Гормон паращитовидной железы – паратирин
– пептид. Механизм действия: 7-TMS р-р ® Gs-белок ® АЦ ® цАМФ ® ПК А ® фосфорилирование белков-эффекторов. Основные
эффекты: уровень Ca2+ и ¯ РО43-,
выделение Ca2+ и (РО43-)
из костей, Å остеолиз остеокластами, Å реабсорбцию Ca2+ почками и секрецию РО43-, Å образование витамина D, Å абсорбцию Ca2+ из ЖКТ.
19.
Основные регуляторы обмена кальция в организме: паратирин (см. в. 18),
кальцитонин (см. в. 17), витамин D3 (1,25 – (ОН)2-
дигидроксихолекальциферол) – стероид, вырабатывается в почках. Действие
витамина D3: 1) уровня Ca2+ и РО43- 2) абсорбции Ca2+ и РО43- из ЖКТ 3) Å реабсорбцию кальция из
костей и поддерживает функционирование систем переноса Ca2+.
20.
Глюкагон – пептид, образуется
α-клетками островков Лангерганса поджелудочной железы. Механизм
действия (7-TMS р-ры): гликогенолиз,
глюконеогенез, образование кетоновых тел и липолиз.
1)
захват иодида I- из плазмы в тироциты с помощью насосов базальной
мембраны Na+/I- и Na+/K+-АТФазы
2) окисление
и органификация иодида в тироцитах с помощью тиреопероксидазы: I-®I. и включение его в состав
тиреоглобулина
3)
экзоцитоз тиреоглобулина в просвет фолликула
4)
иодирование тирозиновых остатков тиреоглобулина в полости фолликула:
3-монойодтиронин (MIT) + MIT ® DIT (3,5-дийодтиронин), DIT + DIT ® T4, MID + DIT ® T3
(очень редко, обычно Т3 образуется из Т4 с помощью дейодазы)
5)
апикальная мембрана (белок пендрин) в виде лепестков розы охватывает капли
коллоида и поглощает их с образованием лизосом, затем Т3 и Т4 попадают в кровь,
где переносятся белками к мишеням.
23.
Гормоны мозгового слоя надпочечников: катехоламины (адреналин,
норадреналин). Химическая природа: производные АК. Механизм действия (цАМФ):1)
секрецию глюкагона и ¯ секрецию инсулина 2) секрецию паратирина 3) гликогенолиз 4) глюконеогенез в печени 5) липолиз.
24.
Принципы синтеза стероидных гормонов (половых, глюко- и минералкортикоидов):
1)
предшественником синтеза стероидов является холестерол
2)
в генотипе нет информации для синтеза непосредственно стероидных гормонов, а
содержится только информация о белках-ферментах, участвующих в их синтезе
3)
стероидные гормоны не запасаются
4)
поступают в кровоток по мере синтеза
25.
Схема синтеза стероидных гормонов:
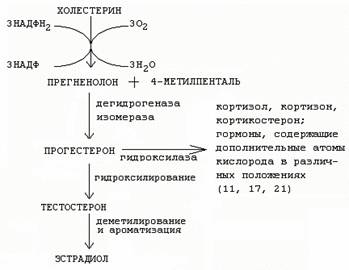
26.
Гормоны половых желез: женские (эстроген, прогестерон, активин, ингибин,
фолистатин, релаксин – синтезируются в яичниках), мужские (андрогены – тестостерон
и дигидрокситестостерон, ингибин, активин – синтезируются в семенниках).
Гормоны стероидной природы: эстроген, прогестерон, тестостерон, белковой
природы: активин, фолистатин, ингибин, релаксин.
Механизм
действия стероидных половых гормонов, кроме эстрогенов: связываются с рецептором в
цитоплазме, затем комплекс гормон-рецептор попадает в ядро. Непосредственно в
ядре располагается рецептор эстрогенов.
Эффект
эстрогенов:
1) Å пролиферация эндотелия 2) Å возбудимость миометрия 3) Å рост протоков молочной
железы 4) Å секреция пролактина (но не
действие) 5) Å транспортные белки печени
6) анаболики 7) приводят к гипотермии 8) задерживают воду.
Функции
прогестерона:
1) Å развитие желез матки,
индуцирует превращение клеток стромы в децидуальные клетки 2) ¯ возбудимость миометрия 3) Å рост альвеол грудной железы
4) катаболик 5) температуру тела 6)
натрийуретик
Эффект
андрогенов:
1) Å сперматогенез 2) Å вторичные половые признаки
3) анаболик
27.
Глюкокортикоиды – гормоны стероидной
природы: кортизол, кортикостерон. Рецепторы расположены в цитоплазме, состоят
из трех частей:
1)
домен АF1 – активатор транскрипции 2) ДНК-связывающий домен (имеет цинковые
пальцы, закрытые белком – ингибитором hsp) 3) гидрофобный карман.
Гормон
+ гидрофобный карман ® сброс белка теплового шока
(hsp) ® освобождение цинковых
пальцев ® димеризация рецепторов
(гомодимер)® связь с ДНК ® запуск транскрипции.
Действие
кортизола:
1) глюконеогенез 2) липолиз и протеолиз 3) Æ усвоение глюкозы 4) Æ иммунный ответ 5) Æ рост костей 6) Å сурфактант 7) Å ферменты ЖКТ 8) модулирует
ЦНС.
28.
Минералкортикоиды: альдостерон –
стероидной природы. Действие альдостерона: 1) реабсорбция натрия почками 2) секреции К+ почками. Рецепторы
располагаются в цитоплазме.
29.
Рецептор инсулина: гликопротеин, 1-TMS-рецептор на поверхности
клеток-мишеней. Гетеродимер, состоит из двух субъединиц – α и β.
Инсулин связывается с α-субъединицей, β-субъединица преобразует
полученный сигнал (обладает тирозинкиназной активностью и содержит участок
аутофосфорилирования).
Г +
рецептор ® изменение конформации
α-субъединиц ® активация тирозинкиназной
активности β-субъединицы ® активация
инсулинорецепторного субстрата (IRS) ® запуск:
а)
фосфатидилинозитолкиназный путь ® ДАГ + ИФ3 ® активация 50 ферметов обмена углеводов,
липидов, белков, активация движения GLUT4.
б)
МАП-киназный путь (митогенактивируемая протеинкиназа) ® Å факторов транскрипции ® синтез белков, стимуляция деления кл.
в)
активация RAS-белка, связанного с рецептором фактора роста.
30,
31. Влияние инсулина на метаболизм углеводов:
1)
на транспорт глюкозы через мембрану: облегчает диффузию гл в клетки, кроме
печеночных за счет увеличения числа переносчиков GLUT4. В печеночных кл: индукция
глюкокиназы® гл в гл-6-ф ® концентрация свободной гл
поддерживается на низком уровне ® гл проникает в кл путем простой диффузии по
градиенту концентрации.
2)
на утилизацию гл: усиливает гликогенез (например, повышает активность
гликогенсинтазы)
3)
на образование гл: ингибирует глюконеогенез (ингибирует синтез ФЕПКК).
4)
на метаболизм гл: ¯ содержание гл в крови.
Расстройство
метаболизма углеводов при диабете: 1) гипергликемия из-за а) пониженного
проникновения гл в клетки б) ¯ утилизации гл различными тканями
в) глюконеогенеза в печени 2) снижение
гликогенеза.
32.
Влияние инсулина на метаболизм липидов:
1)
стимулирует липогенез в жировой ткани (за счет притока ацетил~КоА и НАДФН для
синтеза ВЖК, поддержания нормального уровня ацетил~КоА-карбоксилазы, притока
глицерола) 2) мощный ингибитор липолиза в печени и жировой ткани (ингибирование
гормон-чувствительной липазы)
Расстройство
метаболизма углеводов при диабете: повышенный липолиз ® содержание в плазме СЖК ® кетогенез, кетонурия, кетонемия .
33.
Влияние инсулина на метаболизм белков: усвоение белка, усиливая
утилизацию АК, стимулирует синтез, уменьшает распад (на уровне трансляции
мРНК).
Нарушение
при сахарном диабете: повышенный катаболизм белков ® повышенное содержание АК в плазме, потеря
азота с мочой.
34.
Восстановительный путь обмена глюкозы при сахарном диабете – образование
сорбитола: глюкоза проникает в клетку ® сорбитол (с помощью
альдозоредуктазы и НАДФН+Н+). Это наиболее интенсивно протекает в
артериальных стенках, кл Шванна и т.д. Сорбитол вызывает осмотическое набухание
клеток и нарушение их функций.
Основной
механизм повреждения тканей при сахарном диабете - гликозилирование белков -
не ферментативная реакция глюкозы со свободными аминогруппами белковой
молекулы (лиз, арг). При этом нарушаются функции белков в результате изменения
заряда белковой молекулы, ее конформации или блокирования активного центра, что
приводит со временем к ангиопатиям (повреждениям базальных мембран сосудов).
Недостаток
инсулина ® мобилизация жиров ® заполнение кровеносного русла СЖК и ТАГ ® ингибирование синтеза ВЖК ® катаболические пути не справляются с
избытком образующегося ацетил-КoA ® в
печени из ацетил-КoA синтезируются кетоновые тела ® накопление
в крови (кетоз), т.к. скорость их
образования превышает возможности клеток по их использованию ® метаболический ацидоз.
35.
Метаболизм глюкозы в инсулиннезависимых тканях:
1) глюкоза
проникает в клетку ® сорбитол (с помощью
альдозоредуктазы и НАДФН+Н+)®фруктоза (под действием
сорбитолДГ).
В
норме этот путь происходит в клетках артериальных стенок, клетках Шванна, в
эритроцитах, в хрусталике и сетчатке глаза, в семенниках
2)
глюкоза связывается с аминогруппами белков (гликозилирование), что изменяет
строение белков и нарушает их функции. Может быть гликозилирование гемоглобина,
белков базальных мембран ® изменение капилляров,
утолщение базальных мембран.
36.
Биохимическая диагностика сахарного диабета:
1)
качественное и количественное двукратное определение гл в крови по
глюкозооксидазному методу.
2) тест
на толерантность к глюкозой (пробу с нагрузкой глюкозой).
3)
метод Хагедорна-Йенсена - количественный метод
определения уровня сахара в крови, основанный на способности сахаров
восстанавливать в щелочной среде красную кровяную соль в желтую; о содержании
сахара судят по избытку красной кровяной соли, определяемому титрометрией.
4)
качественное и количественное
определение сахара в мочи (качественные реакции: Тромера, Фелинга,
количественные реакции: глюкозооксидазный метод).
37.
Клинико-диагностические значения оценки гликемических кривых:
1) у больных с разными формами диабета: нарастание
гликемической кривой происходит медленнее, в большинстве случаев отмечается
глюкозурия. Чем тяжелее заболевание, тем позже достигается максимум гликемии и
тем он выше. Понижение кривой происходит очень медленно, чаще оно растягивается
на 3-4 ч.
2) гиперфункция щитовидной железы: гликемические
кривые с более быстрым, чем в норме, подъемом, что вызвано более интенсивным
обменом веществ и возбуждением симпатического отдела ВНС
3) аденома островков Лангерганса, гипотиреоз
(микседема), болезнь Аддисона: низкий исходный уровень кривой, низкая ее
вершина и высокий постгликемический коэффициент.
38.
Функции печени:
1)
гомеостатическая 2) метаболическая (в обмене белков, липидов, углеводов) 3)
экскреторная 4) антитоксическая 5) обмен желчных пигментов.
39.
Роль печени в углеводном обмене – поддержание постоянства глюкозы в
крови:
а)
набором ферментов синтеза и распада гликогена (гексокиназа, глюкокиназа,
гликогенсинтаза, гл-6-фосфатаза)
б)
набором ферментов глюконеогенеза
в) набором
ферментов, превращающих другие гексозы (галактозу, фруктозу) в глюкозу.
40.
Функциональные пробы, характеризующие роль печени в углеводном обмене:
а)
нагрузочная проба галактозой – в норме выведение галактозы в моче не превышает
8% через
б)
нагрузка глюкозой.
41.
Роль печени в обмене липидов (их депонировании):
а)
синтез, распад, удлинение, укорочение ЖК
б)
распад, синтез и модификация СЖК
в)
синтез большинства ЛПНП и 90% ХС в организме
г)
из ХС синтезируются желчные кислоты, входящие в состав желчи.
42.
Роль печени в обмене белков: АК используются для
а) синтеза белков плазмы крови (альбуминов,
глобулинов, факторов свертывания – протромбин, фибриноген, факторы V, VII, IX, X, XI, XII,
ферментов (липопротеинлипаза, холинэстераза)
б)
образования α-кетокислот
в)
глюконеогенеза из глюкогенных АК
г)
кетогенеза из кетогенных АК
д)
получения энергии (в ЦТК)
е)
синтез креатина, холина, мочевой кислоты.
43.
Роль печени в азотистом обмене: см. в. 42
1)
Аммиак, образующийся в реакциях метаболизма в печени и возникающий в процессе
гниения белков в толстом кишечнике, превращается в гепатоцитах в мочевину и
обезвреживается.
2)
В печени синтезируется креатин, затем он поставляется в кровь для использования
в дальнейшем скелетной и сердечной мышцами.
Синтез
креатина:
1) глицин + аргинин ® орнитин + гуанидиноацетат
(под действием аргинилглицинтрансаминазы) 2) гуанидиноацетат + S-аденозилметионин
® аденозилгомоцистеин + креатин (под действием
гуанидиноацетаттрансметилазы). Креатин + АТФ ® креатинфосфат (под
действием креатинфосфокиназы) – депо энергии в мышцах.
Снижение
уровня мочевины в крови наблюдается при заболеваниях: 1) патологическом
изменении значительной части паренхимы печени 2)
недостаточности белка в питании 3) продолжительном голодании 4) врожденном
нарушении нормального протекания цикла мочевины (у детей).
44.
Функциональные пробы, характеризующие белоксинтезирующую функцию печени:
Т.к.
в печени синтезируются основные белки крови – альбумины и глобулины, на основании
определения соотношения этих белков в плазме крови можно судить о
белок-синтезирующей функции печени.
Альбумин-глобулиновый
коэффициент А/Г в норме 1,5-1,7. При острых поражениях печеночной паренхимы A/Г ¯ за счет уменьшения уровня
альбуминов ® падает осмотическое
давление крови ® развитие периферических
отеков. Т.к. синтез g-глобулинов при этом не
нарушается, повышается их концентрация относительно альбуминов и наблюдается
дислипопротеинемия.
45,46.
Печень играет исключительную роль в обезвреживании как поступающих в организм
ксенобиотиков, так и образующихся в организме токсичных и непригодных для
дальнейших превращений продуктов метаболизма.
Антитоксическая функция
печени –
обезвреживание ксенобиотиков, продуктов распада БАВ, сильнодействующих физиологических
веществ, нормальных метаболитов и лекарств следующими способами:
а)
метилирование (вит PP ® N-метилникотинамид ® выводится из организма)
б)
ацетилирование (сульфаниламидные препараты)
в) окисление
(алкоголь, ароматические углеводороды, катехоламины, биогенные амины)
г)
восстановление (нитробензол)
д)
синтез мочевины (аммиак)
е)
коньюгация с сильнополярными отрицательно заряженными молекулами (активными
формами глюкуроновой или серной кислот – УДФ-глюкуроновой кислотой и ФАФС)
(стероидные гормоны, билирубин, продукты гниения белков, фенолы, желчные
кислоты)
ж)
окисление микросомными комплексами ферментов – превращают гидрофобные
соединения в гидрофильные. С помощью монооксигеназ (НАДФ-зависимые с цитохромом P450) окисляются лекарства и
яды, путем восстановления с участием НАДН-зависимых реакций могут быть
инактивированы дисульфидные и нитрогруппы кетонов, альдегидов.
з)
окисление пероксисомными ферментами (оксидазой мочевой кислоты, лактооксидазы,
каталазы)
и)
с помощью цистеин-богатого металлотиопротеина
(связывание и обезвреживание тяжелых металлов Cd2+, Cu2+, Hg2+, Zn2+).
47.
Метаболизм гормонов в печени.
Печень
принимает активное участие в инактивировании различных гормонов (при попадании
их с током крови в печень их активность резко снижается).
Пептидные
гормоны гидролизуются в печени при участии протеолитических ферментов. Два
фермента инактивируют инсулин: 1) восстанавливающий дисульфидные связи в
молекуле инсулина с образованием цепей А и В 2) пептидгидролаза (инсулиназа) –
гидролизует А и В цепи. Катехоламины дезаминируются моноаминооксидазой,
метилируются по гидроксильным группам и коньюгируют с серной или глюкуроновой
кислотами. Стероидные гормоны инактивируются при участии микросомальных
гидроксилаз, а затем коньюгируются. Тироксин путем трансаминирования превращается в
кетопроизводное, а также коньюгируются с глюкуроновой или серными кислотами.
48.
Распад гемоглобина в клетках РЭС.
гемоглобин
+ НАДФН+Н+, О2 (под действием гемооксигеназы + вит. С и
цит. P450)® вердоглобин ® глобин + Fe + биливердин (+НАДФН+ Н+, под
действием биливердинредуктазы) ® билирубин (непрямой, или
свободный).
49.
Обмен билирубина в печени.
При
распаде гемоглобина непрямой билирубин (свободный) поступает в кровь и
связывается с альбуминами плазмы. Затем он поступает в печень, где связывается
с 2 молекулами УДФ-глюкуроновой кислоты под действием
УДФ-глюкуронилтрансфреразы с образованием билирубиндиглюкуронида – прямого
(связанного) билирубина.
50.
Превращение билирубина в ЖКТ.
Прямой
(связанный) билирубин по желчным протоках поступает в тонкий кишечник. Там он
теряет 2 молекулы УДФ-глюкуроновой кислоты с образованием мезобилирубина.
Мезобилирубин в нижних отделах тонкого кишечника превращается в уробилиноген. Затем
90% уробилиногена поступает в толстый кишечник и называется там
стеркобилиноген, 10% уробилиногена по воротной вене возвращается в печень и там
окончательно разрушается. 80% стеркобилиногена покидает организм с калом и под
действием кислорода воздуха превращается в стеркобилин, 20% по геморроидальным
венам попадает в большой круг кровообращения и в почки, где и выводится.
51.
Гемолитическая желтуха (надпеченочная)
– усиленный гемолиз эритроцитов вследствии:
а)
переливания несовместимой крови б) малярии 3) резус-конфликта мать-ребенок 4)
отравления тяжелыми металлами и некоторыми лекарственными препаратами 5) серповидно-клеточной
анемии или талассемии.
Лабораторная диагностика:
а)
т.к. идет усиленный гемолиз эритроцитов,
в крови резко увеличен непрямой билирубин.
б)
печень здорова, поэтому избыток
непрямого билирубина превращается в избыток прямого ® избыток прямого билирубина попадает в
кишечник ® уровень стеркобилина в кале
повышен ® кал шоколадного цвета.
в) повышен
уровень стеркобилина в моче ® моча цвета темного пива.
52.
Паренхиматозная желтуха (печеночная)
– возникает в результате поражения и гибели гепатоцитов. Причины:
гепатиты, рак печени.
Лабораторная диагностика.
а)
гибель гепатоцитов ® увеличение прямого
билирубина в крови и появление его в моче, увеличение АлАТ, АсАТ. Печень
больна, поэтому непрямой билирубин не успевает превращаться в прямой ® увеличение в крови непрямого билирубина.
б)
т.к. прямой билирубин выходит в кровь, в кишечник с желчью его попадает мало ® в моче и кале мало стеркобилина ® кал светлый.
в) печень
поражена ® не разрушается уробилиноген
® повышение уровня уробилина в крови ® появление уробилина в моче ® моча темная.
53.
Обтурационная желтуха (подпеченочная,
механическая) – возникает вследствие закупорки желчного протока. Причины:
1) камни в желчных протоках 2) опухоль головки поджелудочной железы 3) глисты.
Лабораторная диагностика.
а)
закупорка желчных путей ® резкое повышение в крови
прямого билирубина ® повышение прямого
билирубина в моче. Печень не успевает превращать непрямой билирубин в прямой ® повышение в крови непрямого билирубина.
б) закупорка
желчных протоков ® отсутствие стеркобилина в
моче и кале ® ахоличный («белой глины»)
стул, прозрачная моча.
54.
Биосинтез гема и его регуляция.
Hb – хромопротеин, т.к. его небелковая часть окрашена
(гемопротеин). Глобин синтезируется как обычный белок, в синтезе гема – ряд стадий.
Все клетки, содержание ядро, могут синтезировать гем, но наиболее интенсивно
его синтез идет в печени и костном
мозге:
1)
сукцинил~КоА + глицин ® КоА~SН + СО2
+ d-аминолевулиновая кислота (d-АЛК) (под действием 1-d-аминолевулинатсинтазы)
2)
2 d-АЛК ® H2О + порфобилиноген (ПБГ)
(под действием 2-d-аминолевулинатдегидрогеназы)
3)
4 ПБГ --------® протопорфирин IX
(через ряд промежуточных стадий)
4)
протопорфирин IX + Fe2+ ® гем (под действием 3-гемсинтазы, или
феррохелатазы, + вит. В12, Сu2+)
5)
гем + глобин ® гемоглобин
Регуляция синтеза гема.
Ключевой фермент - 1-d-аминолевулинатсинтаза. Ингибируется избытком гема по принципу обратной
связи, а активируется стероидными гормонами.
2-d-аминолевулинатдегидрогеназа и 3-гемсинтаза
ингибируются гемом в меньшей степени. 3-гемсинтаза очень чувствительна к
свинцу, а 2-d-аминолевулинатдегидрогеназа
– ко всем тяжелым металлам.
55.
Энзимодиагностика заболеваний печени:
С
помощью биохимических тестов можно выявить изменения при поражении менее 5% паренхимы
печени, тогда как клинически заболевание проявляется при поражении >80%.
1. Исследование белкового спектра крови.
а) альбуминово-глобулиновый
коэффициент А/Г = 1,5-1,7 в норме. При острых поражениях А/Г¯ за счет уменьшения уровня
альбуминов, при хронических – за счет повышения глобулинов.
б) определение
коллоидной устойчивости (тимоловая и сулемовая проба, проба Самая на b-ЛПН). Первые две положительны при
паренхиматозной желтухе и отрицательны при механической, проба Самая –
наоборот.
2. Исследование пигментного обмена.
3. Исследование антитоксической функции.
Используются нагрузочные тесты (проба Квика-Пытеля): после приема бензоата
натрия он в печени соединяется с глицином с образованием гиппуровой кислоты,
которую определяют в моче.
4. Исследование дезаминирования в печени.
Если остаточный азот повышен за счет азота АК, это значит, что страдает
дезаминирование АК в печени, если увеличение остаточного азота происходит за
счет мочевины, это скорее свидетельствует о нарушении азотовыделительной
функции почек.
5. Исследование мочевинообразовательной
функции.
Азот
мочевины / остаточный азот = 0,5 в норме, при поражениях печени снижается.
6. Исследование гомеостатической функции.
а)
нагрузочная проба галактозой – в норме выведение галактозы в моче не превышает
8% через
б)
нагрузочная проба глюкозой.
7. Исследование активности ферментов плазмы
крови, характеризующих печеночный обмен.
При
заболеваниях паренхимы в крови резко увеличен уровень органо-специфического
фермента – фруктозо-1-фосфат альдолазы, а также возрастает активность АлАТ и в
меньшей степени АсАТ. Увеличена активность ЛДГ5, резко снижена активность
холинэстеразы.
При
незначительных поражениях гепатоцитов: в плазме крови увеличивается активность
цитоплазматических ферментов печени (АлАТ, АсАТ, сорбитолдегидрогеназы, g-глутамилтранспептидазы).
При
сильном поражении гепатоцитов повышается активность митохондриальных ферментов:
глутамилдегидрогеназы, митохондриальной АсАТ.
При
механической желтухе в крови возрастает щелочная фосфатаза и
лейцинаминопептидаза.
При
длительном декомпенсированном поражении снижается активность холинэстеразы,
ЛХАТ, содержание факторов свертывания крови и общее содержание белков крови.
56.
Метаболизм этанола осуществляется
тремя ферментативными системами: 1) алкогольдегидрогеназной (80%) 2)
микросомальной этанолокисляющей системой (МЭОС – 15%) 3) каталазой (5%).
1) Алкогольдегидрогеназа
наиболее активно метаболизирует этанол в печени, преимущественна локализована в
цитозоле клеток (только 10% - в ЭПС и митохондриях). Катализирует реакцию
образования ацетальдегида: этанол + НАД+ ® ацетальдегид + НАДН+Н+.
2) МЭОС
катализирует реакцию: этанол + НАДФН+Н+ + О2 ® ацетальдегид + 2 Н2О.
3) каталаза
катализирует реакцию: этанол + Н2О2 ® ацетальдегид + 2 Н2О.
Образующийся
ацетальдегид далее окисляется ацетальдегиддегидрогеназой в уксусную кислоту,
которая превращается в ацетил-КоА и 1) вступает в ЦТК или 2) идет на синтез ВЖК
и холестерола. В сутки в тканях человека образуется и окисляется 1-
Механизм
развития жировой инфильтрации и дегенерации печени: избыточное потребление этанола ® увеличение содержания в гепатоцитах ВЖК и
холестерола ® в печени происходит
интенсивные распад и синтез фосфолипидов из компонентов нейтрального жира,
однако для данного процесса необходимы неорганические фосфаты и так называемые
липотропные факторы (холин) ® липотропные факторы не
поступают или поступают в малом количестве ® накопление нейтральных
жиров в гепатоцитах ® жировая инфильтрация печени
и ее дегенерация.
57.
Компоненты системы микросомального
окисления (монооксигеназного пути окисления):
1)
неполярный окисляемый субстрат
2)
кислород
3)
дополнительный субстрат (косубстрат) – донор водорода НАДФН+Н+.
4)
флавопротеин
5) цитохром
P450
– связывает субстрат окисления и активирует молекулярный кислород.
58.
Бикарбонатная буферная система крови – наиболее важный буфер организма (10%
буферной емкости крови). Поддерживаемая рН ~ 7,40. Компоненты: Н2СО3/NaHCO3.
Механизм
действия:
1) Н+
+ HCО3- ® Н2СО3 (слабо
диссоциирующая). Последующее снижение концентрации угольной кислоты достигается
в результате гипервентиляции легких и ускоренном выведении СО2.
2)
OH- + H2CO3 ® H2O + HCО3-.
При этом реализуется гиповентиляция легких для сохранения в плазме СО2
Гемоглобиновая
и оксигемоглобиновая буферные системы крови – самые мощные в организме (более 75 всей
буферной емкости крови), функционирует только в сочетании с гидрокарбонатной.
Компоненты: KHb/HHb (гемоглобиновая буферная
система), KHbO2/HHbO2 (оксигемоглобиновая буферная
система).
Механизм
действия:
HbO2- + Н+ « ННbO2® ННb + O2
HHbO2 +
HHb +
Hb- + H+ ® HHb
Бикарбонатная
и гемоглобиновая система взаимосвязаны между собой: КНb + Н2СО3 ® KHCO3 + HHb
59.
Фосфатная буферная система крови – буферная емкость ~ 1% буферной
емкости крови, однако является одной из самых основных в тканях. Компоненты
в клетках: KH2PO4/K2HPO4. Поддерживаемая рН ~ 7,2. Механизм:
H2PO4- (донор протонов) « H+ + HPO42-(акцептор протонов)
Белковые
буферные системы – поддерживают рН в пределах 7,2-7,4. Амфолитные, т.е. имеют и
кислотные (карбоксильные), и основные (амино-) группы в молекуле.
Механизм
действия белковых буферных систем:
|
кислотная
буферная система: |
основная
буферная система |
|
+H3N-R-COOH
+ OH- « +H3N-R-COO- +
H2O +H3N-R-COO-
+ H+ « +H3N-R-COOH |
H2N-R-COO- + H+
« +H3N-R-COO- +H3N-R-COO-
+ |
60.
Структура гемоглобина: 4 молекулы небелкового
компонента – гема (тетрапиррольное кольцо из четырех пиррольных колец,
соединенных между собой метиновыми мостиками (-СН=) - система протопорфирина IX + не
изменяющее валентность Fe2+) и белковый компонент –
глобин (4 белковые субъединицы: 2α- и 2β-субъединицы). Каждая
молекула гема обернута полипептидной цепью
Физиологические
Hb: а) Нb A1 (2α- и 2β-
цепи) – 90-95% б) Hb A2 (2α- и 2s-цепи) – 2,5% в) HbF (2α- и 2g-цепи) – 1,5% у взрослого, 80% у
новорожденного.
Аномальные
гемоглобины
– до 150 типов, возникают в результате мутации генов, кодирующих синтез
глобинов, чаще в результате замены АК в α-
или β-цепи: HbC, HbDα, HbDβ, HbE, HbG, HbI, HbO, HbS (cерповидноклеточной анемии), HbH (все
цепи нормальные, но состоит из четырех β- цепей). Наличие аномальных
гемоглобинов обуславливает различные гемоглобинопатии.
Производные
гемоглобина:
физиологически нормальные а) оксигемоглобин (HbO2 без изменения валентности Fe) б)
карбоHb (HbCO2) и патологические в) метHb (возникает при воздействии
сильных окислителей на ион Fe2+, который становится
трехвалентным Fe3+ и не может переносить кислород) г) карбоксиHb (HbCO –
возникает при отравлении человека угарным газом).
61.
Гипоксия – кислородное голодание –
состояние, возникающее при недостаточном снабжении тканей организма кислородом
или нарушении его утилизации в процессе биологического окисления.
II.Гипоксия при патологических процессах, нарушающих
снабжение тканей кислородом при нормальном его содержании в окружающей среде.
а)
дыхательный (легочной) тип – из-за альвеолярной гиповентиляции вследствие а)
обструкции дыхательных путей (воспаление, отек, спазм) б) уменьшения
дыхательной поверхности легких (отек легкого, пневмония). Часто к гипоксии
присоединяется гиперкапния.
б)
сердечно-сосудистый (циркуляторный) тип – при нарушения кровообращения,
приводящего к недостаточному кровоснабжению органов и тканей.
в)
кровяной (гемический) тип – в результате уменьшения кислородной емкости крови
1) при анемиях из-за а) уменьшения эритроцитов б) снижения содержания Hb в
эритроцитах 2) при отравлениях угарным газом 3) при действии на Hb
сильных окислителей (образование метгемоглобина)
г)
тканевой (гистотоксический) тип – из-за нарушения способности ткани поглощать
кислород из крови из-за 1) угнетения биологического окисления ингибиторами типа
цианида, блокирующего цитохромоксидазу 2) нарушения синтеза ферментов 3)
повреждения мембранных структур клетки.
62.
Механизмы транспорта углекислого газа кровью.
а)
часть СО2 переносится в физически растворенном виде (~ 6-7% всего СО2)
б)
в карбаминовой форме (СО2, присоединенный к гемоглобину посредством
карбаминовой связи) (~ 3-10% всего СО2)
3)
в форме бикарбоната (более 80% всего СО2):
1. KHbO2 ® O2 + KHb (в периферических капиллярах
большого круга кровообращения, кислород поступает при этом в ткани из
эритроцитов).
2. В
обмен на кислород из тканей в эритроцит поступает СО2. В эритроците:
СО2 + H2O ® H2CO3 (под действием
карбоангидразы), КHb + H2CO3 ® K+ + HCO3- + HHb.
3.
Гидрокарбонат ионы выходят из эритроцитов в плазму, взамен в эритроцит
поступают анионы хлора, для которых проницаема мембрана эритроцита. Для
катионов натрия мембрана эритроцита не проницаема, они остаются в плазме и
повышают содержание в ней NaHCO3 (восстанавливает щелочной
резерв крови).
4.
В легочных капиллярах: НHb + О2 ® HHbО2,
HHbО2 + K+ + HCO3-® KHbO2 + H2CO3.
5. H2CO3 ® СО2 + H2O (под действием карбоангидразы). Углекислый
газ диффундирует при этом в легкие.
6.
Т.к. в эритроцитах снижается концентрация гидрокарбонат ионов, в них из плазмы
поступают новые порции гидрокарбонат ионов, а в плазму выходят хлорид ионы.
63.
Индикаторные ферменты крови и их
диагностическое значение:
|
Фермент |
Орган |
Заболевание |
|
АлАТ |
печень,
скелетные мышцы |
паренхиматозные
заболевания |
|
АсАТ |
печень,
скелетные мышцы, сердце, почки, эритроциты |
ИМ,
паренхиматозные заболевания печени, мышц |
|
Альдолаза |
скелетные
мышцы, сердце |
болезни
мышц |
|
Кислая
фосфатаза |
предстательная
железа, эритроциты |
рак
предстательной железы |
|
Щелочная
фосфатаза |
печень,
костная ткань, слизистые оболочки, плацента, почки |
заболевания
костной ткани, печени |
|
Амилаза |
слюнные
железы, поджелудочная железа, яичники (активность повышена на высоте острого
панкреатита) |
заболевания
поджелудочной железы |
|
Холинэстераза |
печень |
отравление
фосфорорганическими инсекцидами, болезни печени |
|
Креатинкиназа |
скелетные
мышцы, ГМК, мозг, сердце |
ИМ,
заболевания мышц |
|
ГлутаматДГ |
печень
(митохондрии) (свидетельствует о глубоком поражении клеток) |
паренхиматозные
заболевания печени |
|
g-глутаматтраспептидаза |
печень,
почки ( при холестазе) |
заболевания
печени, алкоголизм |
|
лактатДГ |
сердце,
печень, скелетные мышцы, эритроциты, л.у. |
ИМ,
гемолиз, паренхиматозные заболевания печени |
64.
Гемостаз – все процессы,
направленные на сохранение крови в кровеносном русле, препятствующие кровоточивости
и обусловливающие восстановление кровотока в случае обтурации сосуда тромбом.
Механизмы
гемостаза: а) сосудисто-тромбоцитарный (микроциркуляторный, первичный,
клеточный) б) коагуляционный (макроциркуляторный, плазменно-тромбоцитарный,
вторичный).
Основные
структурно-функциональные компоненты гемостаза: 1) стенка кровеносного сосуда
2) клетки крови (преимущественно тромбоциты, также эритроциты, лейкоциты) 3)
система свертывания крови.
65.
Функциональные звенья системы свертывания крови и их биологическая роль:
а)
свертывающая (гемокоагуляционная) система – препятствует кровоточивости и
потере крови путем образования нерастворимого фибрина.
б)
противосвертывающая (антитромботическая) система: антикоагулянтная и фибринолитическая
– поддерживают жидкое состояние циркулирующей крови, обуславливают
восстановление кровотока в случае закупорки сосуда тромбом.
66.
Свертывающая система крови – процессы,
направленные на образование в сосуде нерастворимого фибрина, препятствующего
потере крови в случае его повреждения.
Компоненты ССК:
а)
плазменные ферментные факторы гемокоагуляции (факторы I-XIII, высокомолекулярный
кининоген, прекалликреин) – преимущественно сериновые протеазы,
секретируются в кровь из гепатоцитов в
виде прокоагулянтов, осуществляют активацию свертывания крови по механизму
частичного протеолиза.
б) плазменные
не ферментные факторы гемокоагуляции (ф. Va и VIIIа).
в)
коагуляционные тромбоцитарные факторы (Р1-Р11) – образуются тромбоцитами,
участвуют в гемокоагуляции.
г)
ионы Са2+ - 1) активируют некоторые факторы свертывания крови 2)
связывают на тромбопластинах витамин К-зависимые факторы свертывания крови (ф. II, VII, IX, X) 3)
стабилизируют структуру тромбопластина.
д)
надмолекулярные структуры – сосудистая стенка (стимулятор и регулятор
свертывания)
67.
Гемокоагуляция – цепной каскадный
ферментативный процесс, в ходе которого происходит взаимодействие и
последовательная активация ряда сериновых протеаз на фосфолипидных матрицах
(тромбопластинах), заканчивающаяся превращением растворимого фибриногена в
нерастворимый фибрин.
Биологический
смысл каскадного механизма гемокоагуляции: многоэтапный биохимический каскад
обуславливает значительное усиление сигнала, инициирующего свертывание крови.
Фазы гемокоагуляции:
1)
1-ая фаза – образование протромбиназы (активного тромбопластина крови): 4 мин
50 с – 6 мин 50 с.
2)
2-ая фаза – образование тромбина: 2-5 с.
3) 3-ая
фаза - образование фибрина: 2-5 с.
4) 4-ая
фаза, посткоагуляционная, - ретракция, т.е. образование гемостатически
полноценного сгустка: 55-85 мин.
69.
Каскад реакций гемокоагуляции происходит на фосфолипидных микромембранах
(фосфолипидных матрицах), источником которых служат:
а)
фрагменты плазматических мембран активированных тромбоцитов (P3),
эритроцитов (эритропластин) и др. клеток
б)
фосфолипидный компонент тканевого тромбопластина (ф. III – содержит белок апо B III)
70.
Отличия внешнего и внутреннего механизма гемокоагуляции:
1) внешний
механизм – тромбопластин приходит извне из поврежденных тканей, внутренний
механизм – все необходимые факторы, в том числе и тромбопластин, находятся в
кровеносном русле
2)
внутренний механизм – более медленный процесс, чем внешний
3) внутренний
механизм включает большее число факторов свертывания, чем внешний.
Общие
этапы: начиная со 2-ого (образование тромбина).
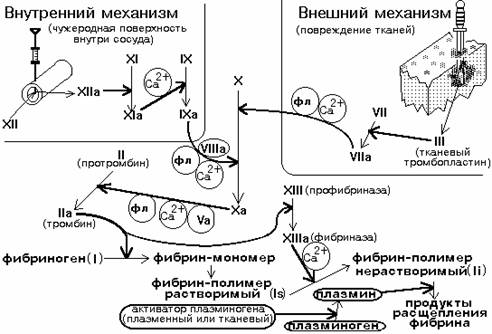
71,72
. Внешний механизм свертывания крови запускается при 1) появлении в
кровотоке обломков клеточных мембран в результате травмы 2) продукции тканевого
тромбопластина эндотелиоцитами при стазе крови, гипоксии, ацидозе, действии на
эндотелий протеиназ и токсинов.
73,
74, 75,76,77, 78, 79, 80, 81. Внутренний механизм свертывания крови
запускается а) контактом крови с
измененной или чужеродной поверхностью, по смачиваемости отличной от эндотелия
(поврежденная стенка сосудов или измененная вследствие васкулитов,
атеросклероза, интоксикации) б) иммунными комплексами, адреналином, жирными
кислотами, холестеролом, бактериальными липопротеинами.
82.
У людей с наследственной недостаточностью фактора Хагемана кровь не
сворачивается в пробирке, т.к. при этом выключается внутренний механизм
гемокоагуляции. В организме больного кровь сворачивается по внешнему пути.
83.
Роль тромбоцитов в процессе гемокоагуляции:
1) участвуют,
как и другие клетки крови, в образовании первичного клеточного тромба
2)
участвуют в активации гемокоагуляции (создают поверхность для взаимодействия и
активирования факторов свертывания крови)
3)
защищают факторы свертывания от разрушения ингибиторами плазмы
4)
выделяют факторы, активирующие процесс тромбообразования
84.
Концентрация фибриногена в крови: 2,0-4,0 г/л. Схема превращения
фибриногена в фибрин:
фибриноген
(А2α2В2β2g2) ®фибринопептиды А и В + фибрин-мономер (α2β2g2) (под действием тромбина) ® растворимые фибрин-мономерные комплексы® фибрин S (нестабилизированный
фибрин-полимер) ® фибрин I
(стабилизированный фибрин-полимер) (под действием фибринстабилизирующего
фактора ф. XIII).
Растворимый,
или нестабилизированный полимер фибрина (фибрин S) – распадается в кислой
среде и в растворе мочевины, легко расщепляется протеиназами. Нерастворимый,
или стабилизированный, фибрин (фибрин I) – резистентный к протеазам,
более эластичный и прочный.
86.
Витамин К – по структуре схож с
витамином E, имеет хиноновое кольцо и изопреновый радикал.
Разновидности витамина K: вит. К1 (филлохинон) и
вит. К2 (менахинон-6). Источники: смешанная пища (особенно зеленые растения) и кишечная
микрофлора.
Роль витамина К в
гемокоагуляции (работает в составе g-глутамилкарбоксилазы):
а)
антигеморрагический фактор – пострансляционное созревание факторов II, VII, IX, X
б)
участвует в созревании витамин К-зависимых антикоагулянтов (протеинов C и S)
87.
Антикоагулянтная система – ряд
ингибиторов свертывания, осуществляющий контроль скорости активирования
факторов и реакций между ними. Физиологические
антикоагулянты:
а)
первичные – постоянно синтезируются в организме и с постоянной скоростью
выделяются в кровоток, взаимодействуют только с активными факторами коагуляции,
нейтрализуя их (антитромбин III, гепарин, α2-макроглобулин,
протеины С и S, ЛАКИ и др).
б)
вторичные – образуются из факторов свертывания и других белков в процессе
свертывания крови, фибринолиза и активации других протеолитических систем
(антитромбин I, метафактор Va, метафактор XIа,
продукты фибринолиза, продукты деградации фибриногена)
88,
89. Наиболее значимые естественные
антикоагулянты:
а)
антитромбин III – необратимо ингибирует большинство сериновых
протеаз свертывающей системы (ф. IIa, IXa, Xa, XIa, XIIa), основной плазменный
кофактор гепарина, особенно ингибирует тромбин.
б)
гепарин – в 1000 раз повышает активность антитромбина III.
в)
протеины C и S – разрушают факторы ф.Va, VIIIa и
ингибируют образование фактора Xa и тромбина.
г) α2-макроглобулин –
препятствует действию тромбина на фибриноген
д)
ЛАКИ – ингибирует внешний механизм свертывания, связываясь с факторами VIIa и Xa.
90.
Гепарин – активирует антитромбин III,
повышая его активность в 1000 раз, а АТ III препятствует сворачиванию
крови, ингибируя большинство факторов свертывания. Также гепарин самостоятельно
способен ингибировать ряд протеиназ.
91.
Дикумарол – антагонист витамина К,
он ингибирует восстановление хиноновых производных витамина К в активные
гидрохиноновые формы, препятствуя созреванию вит. К-зависимых факторов системы
свертывания, что сопровождается выключением плазменных факторов VII, IX, X, II из
процесса коагуляции крови. Свертывание крови в пробирке сохраняется при
добавлении в нее дикумарола, т.к. дикумарол оказывает эффект не сразу, а спустя
несколько часов или дней, действуя продолжительно.
92.
Участники плазминовой системы:
а)
плазмин и его профермент – плазминоген
б)
активаторы плазминогена (тканевой активатор плазминогена, урокиназа)
в) проактиваторы плазминогена
г) ингибиторы плазмина (α2-антиплазмин,
α2-макроглобулин, α1-антитрипсин)
д) ингибиторы активаторов плазминогена (ПАИ-1,
ПАИ-2, ПАИ-3, ПАИ-4).
93.
Плазминовая система:
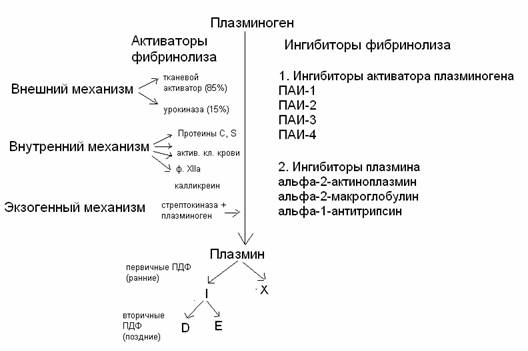
94.
Активаторы плазминогена и их
происхождение:
а)
фактор Хагемана, прекалликреин, высокомолекулярный кининоген – белки крови
б)
стрептокиназа – продуцируется β-гемолитическими стрептококками
в)
урокиназа – продуцируется почечной тканью и эпителием мочевыводящих путей
г) тканевой
активатор плазминогена – синтезируется эндотелием сосудов
д)
кровяные активаторы плазминогена – содержатся в клетках крови (эритроциты,
лейкоциты, тромбоциты)
95.
Физиологические ингибиторы плазмина: α2-антиплазмин, α2-макроглобулин,
α1-антитрипсин, антитромбин III, С1-инактиватор,
интер-α2-антитрипсин.
96.
Комплексные соединения гепарина, возникающие в крови при активации
противосвертывающей системы, обратимы и диссоциируют, свободный гепарин
образует комплекс с АТIII и усиливает его активность
(до 1000 раз) ® ингибирование тромбина и
других сериновых протеиназ ® препятствие свертыванию
крови.
97.
Нарушения в системе гемостаза могут привести к: 1) геморрагиям
(кровотечениям) 2) тромбозам и тромбоэмболиям 3) тромбогеморрагическому
синдрому (ДВС-синдрому)