Данные вопросы не претендуют на
АБСОЛЮТНУЮ ПРАВИЛЬНОСТЬ и, возможно, содержат некоторые погрешности. Предназначены
для САМОПОДГОТОВКИ к коллоквиуму 2 по биохимии, а не в качестве шпоры.
1. См. вопросы 1-10.
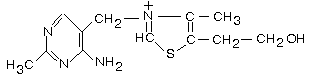
2. ВИТАМИН B1 (тиамин,
антиневритный)
|
|
Химическая природа – два кольца – пиримидиновое и тиазоловое,
объединенные метиленовой связью.
Коферментные формы: тиаминмонофосфат, тиаминтрифосфат (редко),
тиаминпирофосфат (ТПФ, тиаминдифосфат, кокарбоксилаза) (встречается наиболее
часто).
Участие в метаболизме: в форме ТПФ является составной частью четырех
ферментов:
а)пируватдегидрогеназного
комплекса
б)альфа-кетоглутаратдегидрогеназного
комплекса
в)фермента транскетолазы
(участвует в переносе гликольальдегидного радикала от кетосахаров на
альдосахара)
г) фермента дегидрогеназы
γ-оксикетоглутаровой кислоты.
ТПФ также участвует в
окислительном декарбоксилировании глиоксиловой кислоты и α-кетокислот,
образующихся при распаде АК с разветвленной боковой цепью.
Суточная потребность - 1.5 мг/сутки.
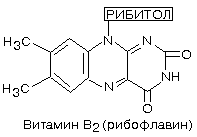
3. ВИТАМИН В2 (рибофлавин,
витамин роста)
|
|
Химическая природа – гетероциклическое соединение – изоаллоксазин
(сочетание бензольного, пиразинового и пиримидинового колец), к которому в
положении 9 присоединен пятиатомный спирт рибитол.
Коферментные формы: флавинмононуклеотид (ФМН)
и флавинадениндинуклеотид (ФАД)
- простетические группы
флавиновых ферментов.
Участие в метаболизме: флавиновые ферменты участвуют в 2-х типах хим.
реакций:
а) прямое окисление с
участием кислорода, т.е. дегидрирование исходного субстрата или промежуточного
метаболита (оксидазы L- и D-АК,
глициноксидаза, ксантиноксидаза и др.)
б) перенос электронов и
протонов от восстановленных пиридиновых коферментов (играют главную роль в
биологическом окислении)
Суточная потребность: 2-4 мг/сутки.
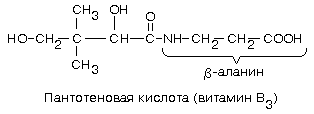
4. ВИТАМИН В3
(пантотеновая кислота, антидерматитный)
|
|
Химическая природа: β-аланин
и 2,4-дигидрокси-диметил-масляная кислота.
Коферментная форма: HS-KoA (кофермент или коэнзим А - кофермент
ацилирования).
Строение КоА: а) тиоэтиламин б) пантотеновая кислота в) 3’-фосфоаденозин-5’-дифосфат.
Участие в метаболизме: HSКоА -
кофермент ацилирования, то есть входит в
состав ферментов, которые катализируют перенос ацильных остатков. Поэтому В3 участвует:
а) в β-окислении жирных
кислот и их биосинтезе
б)в окислительном декарбоксилировании α-кетокислот
(пируват, α-кетоглутарат)
в) в биосинтезе
нейтрального жира, липоидов, стероидов,
гема гемоглобина, ацетилхолина.
Суточная потребность: 10мг/сут.
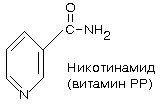
5. ВИТАМИН B5
(витамин PP, никотиновая кислота, ниацин, никотинамид,
антипеллагрический)
|
|
Химическая природа: соединение пиридинового ряда, содержащее амидную
группу.
Коферментные формы: НАД и НАДФ (входит в состав коферментов
никотинамидных дегидрогеназ).
Участие в метаболизме: а) входит в состав коферментов большого числа
обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ
б) НАД и НАДФ выполняют
роль промежуточных переносчиков электронов и протонов между окисляемым
субстратом и флавиновыми ферментами.
Суточная потребность: 15-25 мг/сутки.
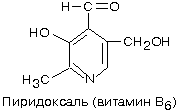
6. ВИТАМИН В6
(пиридоксин, антидерматитный)
|
|
Химическая природа: производное 3-оксипиридина. Производные
отличаются природой замещающей группы в положении 4 пиридинового ядра.
Коферментные формы: пиридоксальфосфат, пиридоксамин.
Участие в метаболизме:
а) играет ключевую роль в
азотистом обмене
б)B6 в
форме пиридоксальфосфата является
простетической группой аминотрансфераз (катализируют обратимый перенос
аминогруппы от АК на α-кетокислоту) и декарбоксилаз АК (осуществляет
необратимое отщепление CO2
от карбоксильной группы АК с образованием биогенных аминов)
в)необходим для некоторых
реакций обмена аминокислот
(неокислительное дезаминирование серина и треонина, окисление триптофана)
г)участвует в
реакциях синтеза гема гемоглобина (синтез δ-аминолевулиновой
кислоты – предшественницы гема).
Суточная потребность взрослого человека:
0.15-0.20 мг.
7. ВИТАМИН B9
(ФОЛИЕВАЯ КИСЛОТА, ВC)
Химическая природа: 3
структурных единицы – остаток птеридина, ПАБК (парааминобензойная кислота) и
глутаминовая кислота.
![]()
Коферментная форма: тетрагидрофолиевая кислота (ТГФК)
Участие в метаболизме:
а)ТГФК является
коферментом ферментов, переносящих одноуглеродные радикалы (формильную –СНО,
метильную –СН3, метиленовую –СН2-, метенильную –СН=,
оксиметильную –СН2ОН, формиминогруппу –СН=NН).
б) переносит
одноуглеродистые фрагменты при биосинтезе метионина и тимина, серина,
образовании пуриновых нуклеотидов и т.д.
Суточная потребность: 0.2 - 0.4 мг.
8. ВИТАМИН В12
(кобаламин, антианемический витамин)
Формула - стр.158 учебника Коровкина или стр.168 учебника
Николаева.
Химическая структура – порфириноподобное корриновое ядро, содержащее
центральный атом кобальта, соединенный с атомами азота четырех восстановленных
пиррольных колец и с атомом азота 5,6-диметилбензимидазола.
Коферментные формы: метилкобаламин (CH3-B12), дезоксиаденозилкобаламин (дАВ12)
Участие в метаболизме:
а) реакции трансметилирования – метилкобаламин
выполняет роль промежуточного переносчика метильной группы (синтез метионина и
ацетата)
б) перенос водорода в
реакциях изомеризации (глутаматмутазная реакция – взаимопревращения
глутаминовой и β-метиласпарагиновой кислот и т.д.)
в) предполагается участие
в реакциях трансметилирования и дезаминирования
Суточная потребность: 2.5-5
мкг.
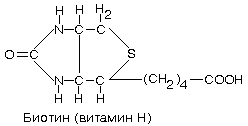
9. ВИТАМИН “Н” (БИОТИН, коэнзим R, антисеборейный)
|
|
Химическая природа: циклическое производное мочевины (имидазоловое и тиоэфирные
кольца), боковая цепь которого представлена валериановой кислотой.
Коферментные формы: остаток биотина, связанный с -аминогруппой
остатка лизина (биоцитин).
Участие в метаболизме:
биотиновые ферменты катализируют два основных типа реакций:
а) реакции
декарбоксилирования (с участием CO2
или HCO3-),
сопряженные с распадом АТФ. Пример: ацетил-КоА и пируваткарбоксилазные реакции.
б) реакции транскарбоксилирования
(без участия АТФ) – обмен карбоксильной группой между субстратами. Пример:
обратимое превращение пировиноградной и щавелевоуксусной кислот.
в) имеют важное значение
в синтезе ВЖК, белков, пуриновых нуклеотидов.
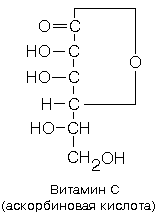
10. ВИТАМИН “С”(аскорбиновая кислота,
антицинготный, антискорбутный)
|
|
Химическая структура: лактон
кислоты со структурой, близкой к структуре L-глюкозы. Является сильной кислотой. Природные
изомеры, обладающие витаминной активностью, относятся к L-ряду.
Коферментные формы: не известны.
Участие в метаболизме:
биологическая роль связана с его участием в окислительно-восстановительных
реакциях:
1. Витамин С, являясь сильным восстановителем, играет роль кофактора в
реакциях окислительного гидроксилирования, что необходимо для окисления
аминокислот пролина и лизина в оксипролин и в оксилизин в процессе биосинтеза
коллагена.
2. Участвует в синтезе стероидных гормонов коры надпочечников
(кортикостероидов).
3. Участвует в синтезе аминокислоты триптофана.
4. Способствует распаду
тирозина и гемоглобина в тканях.
5. Необходим для
всасывания железа.
6. Участвует в
неспецифической иммунной защите организма.
Суточная потребность - около 100 мг в сутки.
Лечебная доза - до 1-2 г в сутки.
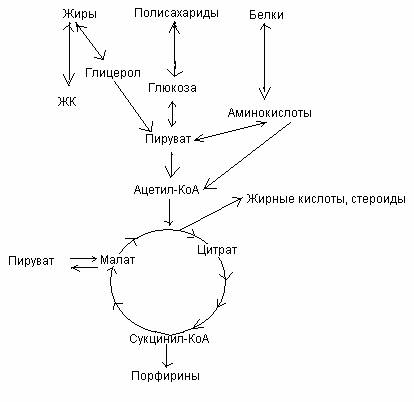
11. Катаболизм (диссимиляция) – расщепление крупных молекул до более
простых веществ в результате окислительных процессов или процессов гидролиза и
фосфоролиза, сопровождающееся разрывов
ковалентных связей и высвобождением энергии.
Примеры: гликолиз, гликогенолиз, окисление жирных кислот.
12. Анаболизм (ассимиляция) – синтез сложных органических соединений из
простых молекул в результате восстановительных процессов (как правило),
сопровождающийся образованием связей между малыми молекулами в процессе синтеза
более высокомолекулярных соединений и осуществляющийся с затратой энергии.
Примеры: глюконеогенез, синтез жирных
кислот, фотосинтез у растений.
13.
Отличия катаболизма от анаболизма:
|
Отличительный признак |
Катаболизм |
Анаболизм |
|
1. Энергия |
Высвобождается (экзергонический процесс) |
Затрачивается (эндергонический процесс) |
|
2. Характер процесса |
Окислительный |
Восстановительный |
|
3. Локализация в клетке
(компартментация метаболических процессов) |
Цитоплазма, митохондрии, лизосомы |
Цитоплазма клетки,
рибосомы, ЭПС, КГ, ядро |
|
4. Обратимость реакций |
Практически необратимы |
В основном обратимы |
Также процессы
катаболизма и анаболизма различаются по
механизмам регуляции.
Уровни взаимосвязи между ката– и
анаболизмом.
1. На уровне
источников углерода (субстратов).
Продукты катаболизма –
исходные субстраты для продуктов анаболизма. Важнейшие метаболиты, на уровне
которых происходит пересечение метаболических путей: глюкозо-6-фосфат, пируват,
ацетил-КоА.
2. На уровне
восстановленных эквивалентов.
В процессе катаболизма
происходит восстановление кофермента, который затем используется для
анаболических процессов.
НАДФН – основной донор
электронов в восстановительных реакциях биосинтеза. НАДН и ФАДН2 –
основные акцепторы и переносчики электронов при окислении «топливных молекул».
3. На энергетическом
уровне.
Катаболизм основных
пищевых веществ сопровождается высвобождением энергии, которая может
аккумулироваться в форме АТФ. При анаболических процессах происходит
потребление АТФ с образованием АДФ и неорганического фосфата, используемых в
реакциях диссимиляции для нового синтеза АТФ.
14. Макроэргические соединения (греч. makros большой + ergon работа, действие) – соединения, содержащие
богатую энергией (макроэргическую) связь, при гидролизе которой изменения
свободной энергии системы составляют более 5 ккал/моль.
Все
известные М.с. содержат фосфорильную (—РО3Н2) или
ацильную группы и могут быть описаны
формулой Х—Y, где Х — атом азота, кислорода, серы или углерода, а Y —
атом фосфора или углерода. Реакционная способность М.с. связана с повышенным
сродством к электрону атома Y, что обусловливает высокую свободную энергию
гидролиза макроэргической связи.
Примеры – фосфоенолпируват, 1,3-дифосфоглицерат,
креатинфосфат, ацетил-КоА, АТФ, АДФ, пирофосфат.
15. Адениловая система – система адениловых нуклеотидов, которая включает
в себя АТФ, АДФ, АМФ, неорганический фосфат и ионы Mg2+.
Роль адениловой системы:
1) играет центральную
роль в энергообмене всех клеток
2) благодаря
неустойчивости АТФ энергия ее концевой фосфоангидридной связи АТФ может
использоваться на синтез фосфорилированных метаболитов, имеющих свободную
энергию гидролиза меньше, чем АТФ. Обратное превращение АДФ в АТФ требует
энергии.
Основные процессы,
использующие энергию гидролиза АТФ:
1. Синтез различных веществ.
2. Активный транспорт
(транспорт веществ через мембрану против градиента их концентраций). 30% от
общего количества расходуемого АТФ приходится на Na+,К+-АТФазу.
3. Механическое движение
(мышечная работа).
16. Реакции и процессы, сопряженные
с гидролизом АТФ, в клетках животных и растений:
1. Клетки скелетных мышц (главная функция – мышечное сокращение)
широко используют катаболизм энергосубстратов (анаэробный гликолиз у белых мышечных волокон и окислительное фосфорилирование в красных мышечных волокнах) и
запасание выделяющейся энергии в форме АТФ – основного источника энергии для
сокращения и расслабления.
2. Кардиомиоциты - постоянно
сокращаются и расслабляются, поэтому используют аэробный катаболизм энергосубстратов и интенсивный синтез АТФ, имеют высокую
окислительную способность.
3. Гепатоциты– основные структуры обезвреживания веществ и
биосинтеза, обеспечивают энергосубстратами мозг, мышцы и другие ткани. Содержат
много митохондрий, активно идут процессы микросомного
окисления, глюконеогенез, синтез мочевины и кетоновых тел.
4. Нейроны– основная работа – транспорт ионов для генерации ПД.
Интенсивный дыхательный обмен, высокая гликолитическая
и окислительная способность. Не содержат запасов энергосубстратов, не
окисляют жирные кислоты. Основной энергосубстрат – глюкоза.
5. Адипоциты– основное место запасания, мобилизации и синтеза
триацилглицеролов. Основной источник глицерол-3-фосфата в процессах синтеза – глюкоза. Пентозофосфатный путь.
6. Клетки почек– выполняют осмотическую работу, активный мембранный
транспорт в ходе образования мочи, поддержание кислотно-щелочного баланса. В
качестве энергосубстратов используют жирные кислоты, лактат, кетоновые тела.
Идет интенсивное образование ионов
аммония и глюконеогенез.
7. Эритроциты– транспорт О2 и СО2. Не имеют
митохондрий, получают энергию путем анаэробного
гликолиза. Синтезируют 2,3-дифосфоглицерат, способствующий высвобождению О2
из гемоглобина в тканях.
17. Механизмы образования АТФ в
клетках животных и растений:
а) Фотосинтетическое фосфорилирование – синтез АТФ у растений за счет квантов
солнечной энергии.
б) Окислительное фосфорилирование – синтез АТФ за счет энергии,
выделяющейся при окислении водорода субстрата кислородом с участием дыхательной
цепи. Основной способ синтеза АТФ для большинства клеток.
в) Субстратное фосфорилирование – синтез АТФ за счет энергии
гидролиза макроэргической связи субстрата (пример: фосфоглицераткиназная и
пируваткиназная реакции анаэробного гликолиза).
Для митохондрий характерно ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ.
18. Окислительное фосфорилирование –
синтез АТФ за счет энергии, выделяющейся при окислении водорода органических
субстратов кислородом с участием дыхательной цепи.
Основные положения хемиосмотической
теории Митчелла:
а) Энергия, выделяющаяся при транспорте электронов I, III и IV комплексами дыхательной цепи, используется для
перекачивания протонов в межмембранное пространство, генерируя градиент pH.
б) Обратный поток протонов по протонным каналам АТФ-синтазы в матрикс
обеспечивает энергией головку АТФ-синтазы для синтеза АТФ.
19. Метаболический путь –
последовательность химических превращений конкретного вещества в клетке:
а) Циклический метаболический путь
– замкнутая последовательность
химических превращений, приводящая в итоге к регенерации исходного вещества. Примеры:
цикл лимонной кислоты, орнитиновый цикл мочеобразования Кребса.
б) Линейный метаболический путь
– линейная последовательность химических реакций. Примеры: гликолиз,
пентозофосфатный путь.
Регуляторные ферменты – ферменты, регулирующие метаболизм клеток, которые обычно располагаются либо в начале
метаболических путей, либо в местах ключевых разветвлений, где сходятся два и
большее число путей и которые катализируют в клетке либо практически
необратимые реакции, либо реакции, протекающие наиболее медленно. Примером
может служить фосфофруктокиназа-1, ацетил-КоА-карбоксилаза,
пируваткарбоксилаза, протеинкиназа.
20. Цикл Кребса – центральный метаболический путь.
|
|
Цикл
Кребса является центральным метаболическим путем, т.к. 1)
связывает в клетке процессы катаболизма и анаболизма (пример: образующийся оксалоацетат используется в
процессах глюконеогенеза, синтеза заменымых АК, цитрат – в синтезе жирных
кислот и т.д.) 2)
объединяет белки, жиры, углеводы, в нем сходятся почти все метаболические
пути 3)
является общим путем окончательного окисления большей части органических
молекул в форме ацетил-КоА, играющих роль клеточного «топлива» 4)
является основным путем, обеспечивающим энергией большинство клеток. |
21.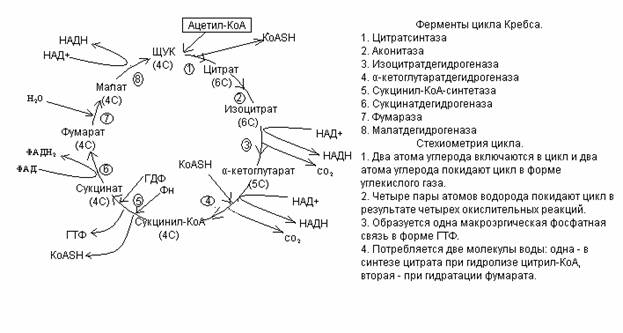
Энергетический баланс
окисления ацетил~КоА: 1 ГТФ в ходе ЦТК + 3*3 АТФ (за счет НАД-переносчика) + 2
АТФ (за счет ФАД-переносчика) = 12 АТФ
22. См. вопрос 21.
Витамины, принимающие участие в
работе цикла:
|
Витамин |
Кофермент в составе витамина |
|
Тиамин |
ТПФ |
|
Никотиновая кислота |
НАД |
|
Рибофлавин |
ФАД |
|
Пантотеновая кислота |
КоА |
Также для нормальной
работы цикла необходимо витаминоподобное вещество – липоевая кислота.
Недостаток хотя бы одного
из витаминов, используемых в синтезе небелковых компонентов ферментов цикла,
сопровождается лактатным ацидозом и
нарушением энергопродукции в клетке.
23. Катаболическая функция цикла Кребса:
1) конечный путь
окисления большинства органических веществ
2) основной источник
запасания энергии в клетке в форме АТФ
Кол-во АТФ, образуемых
при окислении тирозина до фумарата: 3 АТФ (за счет НАД в результате остатка
цикла) + 2 * 12 АТФ (т.к. фумарат содержит 4 атома углерода, то они
элиминируются через два полных оборота цикла, а в каждом цикле образуется 12
АТФ) = 27 АТФ.
24. Кол-во АТФ,
образуемых при окислении пролина до α-кетоглутарата: 3*2 АТФ (от НАД) + 2 АТФ (от ФАД)
+ ГТФ (в результате остатка цикла) + 2 *
12 АТФ (т.к. α-кетоглутарат содержит 5-1 атом углерода, то они
элиминируются через два полных оборота цикла, а в каждом цикле образуется 12
АТФ) = 33 АТФ.
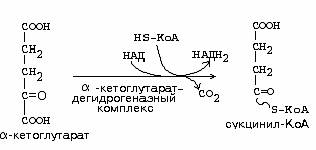
25. Кол-во АТФ,
образуемых при окислении моля аспарагина до оксалоацетата: 2 * 12 АТФ (т.к. оксалоацетат содержит 4 атома углерода, то
они элиминируются через два полных оборота цикла, а в каждом цикле образуется
12 АТФ) = 24 АТФ.
26. См. вопрос 24.
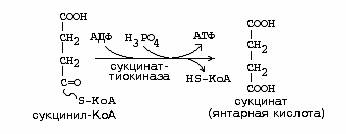
27. Кол-во АТФ,
образуемых при окислении моля метионина до сукцинил-КоА: 1 ГТФ + 2 АТФ (за счет ФАД) + 3АТФ (за счет
НАД) в результате остатка цикла + 2 * 12 АТФ (т.к. сукцинил-КоА содержит 4 атома углерода, то
они элиминируются через два полных оборота цикла, а в каждом цикле образуется
12 АТФ) = 30 АТФ.
28. См. вопрос 21.

29. Реакции ЦТК, катализируемых дегидрогеназами:
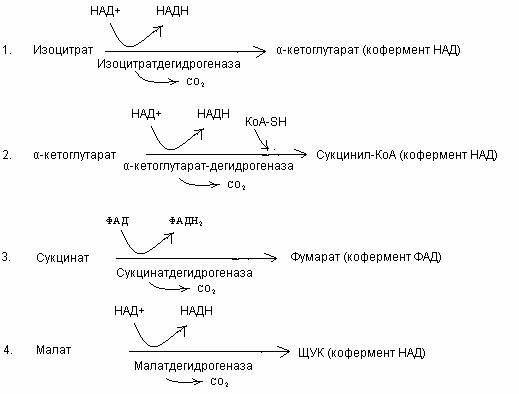
30. Окислительное фосфорилирование – синтез АТФ за счет энергии,
выделяющейся при окислении водорода органических субстратов кислородом с участием дыхательной цепи.
Этапы (комплексы) дыхательной цепи:
I
комплекс (НАДН: убихинон-оксидоредуктаза) – принимает электроны от митохондриального НАДН и транспортирует их на
коэнзим Q.
Протоны при этом транспортируются в ММП. Промежуточным акцептором и
переносчиком протонов и электронов являются ФМН и железо-серные белки. Разделяет поток протонов и электронов.
II
комплекс (Сукцинат: убихинон-оксидоредуктаза) – включает сукцинатдегидрогеназу,
транспортирует электроны от сукцината на убихинон (КоQ) с образованием промежуточного ФАДН2 и с участием железосерных белков.
III
комплекс (Убихинол: цитохром с-оксидоредуктаза) – имеет в составе цитохромы b и c1 и
железо-серные белки.
Транспортирует электроны от КоQ через цитохромы b и c1
на цитохром c. Разделяет поток протонов и электронов (протоны транспортируются в ММП, а
электроны следуют далее по цепи).
IV
комплекс (Цитохромоксидаза – в составе -
атомы меди и группы гема) – содержит цитохромы а и а3 и обладает свойствами фермента.
Электроны транспортируются с III на IV комплекс с участием промежуточного подвижного
переносчика цитохрома c. Транспортирует электроны с на молекулярный
кислород. Способен перекачивать протоны из матрикса в ММП.
Субклеточная
локализация: митохондрии (в
основном, внутренняя мембрана, матрикс и ММП).
При недостатке кислорода
процесс окислительного фосфорилирования прекращается. Механизм: НАД и
ФАД в митохондриях могут быть регенерированы только при условии переноса
электронов на молекулярный кислород. При недостатке кислорода переноса протонов
и электронов из ЦТК на дыхательную цепь не происходит и процесс ингибируется.
31. См. вопрос 18.
Разобщители
окислительного фосфорилирования – вещества, нарушающие систему сопряжения
тканевого дыхания и фосфорилирования.
Могут обладать
следующими свойствами:
а) увеличивают проницаемость
внутренней мембраны для протонов и других катионов
б) являются
альтернативными акцепторами электронов, транспортирующими электроны в обход одного или нескольких
комплексов дыхательной цепи.
32. При увеличении
концентрации АДФ потребление кислорода митохондриями возрастет, т.к. увеличится
интенсивность катаболических реакций, направленных на синтез АТФ в результате дыхательного контроля.
Механизм. Потребление кислорода находится в прямо пропорциональной зависимости от
потребности в АТФ. Когда увеличивается потребность в АТФ, т.е. когда возрастает
соотношение АДФ/АТФ, адениловые нуклеотиды стимулируют по аллостерическому механизму метаболические процессы и поглощение
кислорода возрастает.
33. Пункты
фосфорилирования – участки в дыхательной цепи, где энергия транспорта
электронов используется на генерацию протонного градиента, а затем в ходе
фосфорилирования запасается в форме АТФ:
1-ый: между
пиридинзависимой и флавинзависимой дегидрогеназами
2-ой: между цитохромами b и c1
3-ий: между цитохромами а
и а3
Количество энергии,
выделяемой в реакции переноса электронов по дыхательной цепи, можно определить по изменению редокс-потенциала
(потенциала, образуемого переносимыми электронами), который пропорционален
изменению свободной энергии системы ∆G0’.
34. Нет. НАДФН служит
донором электронов в восстановительных
биосинтезах и располагается преимущественно в цитозоле в отличие от НАДН, который окисляется кислородом
дыхательной цепи с сопутствующим генерированием АТФ и располагается в
матриксе митохондрий.
35. Пиридинзависимые субстраты тканевого дыхания: изоцитрат, малат, α-кетоглутарат, β-гидроксиацил-КоА,
гидроксибутират, пируват, α-кетоглутарат, пролин.
Место включения в
дыхательную цепь: I комплекс (НАДН:
убихинон-оксидоредуктаза).
36. При окислении сукцината
в фумарат коэффициент фосфорилирования P/O=2.
37. С первым комплексом
дыхательной цепи связаны реакции окисления: 1) изоцитрата в α-кетоглутарат, 2) α-кетоглутарата в
сукцинил-КоА, 3) малата в оксалоацетат (ЩУК).
При этом можно получить 3
АТФ на каждую реакцию окисления.
38. При окислении
изоцитрата в α-кетоглутарат можно получить три молекулы АТФ.
Место включения α-кетоглутарата в дыхательную цепь - I комплекс (НАДН: убихинон-оксидоредуктаза).
39. При окислении α-кетоглутарата в
сукцинил-КоА коэффициент фосфорилирования Р/О=3. См. вопрос 38.
40. При окислении
яблочной кислоты (малата) в ЩУК P/O=3. Участки сопряжения транспорта электронов и
фосфорилирования см. вопрос 33.
41. При окислении
сукцината в фумарат образуется 2 АТФ.
42. При блокаде дыхательной
цепи производными барбитуровой кислоты (ротеноном, аминобарбиталом
(амиталом) I комплекс (ФМН и железо-серные белки) будет
находиться
в восстановленном
состоянии, остальные переносчики – в окисленном.
43. Малонат –
конкурентный ингибитор сукцинатдегидрогеназы (II комплекс), поэтому в митохондриях будет
накапливаться сукцинат.
44. При блокаде
дыхательной цепи цианидами (а также СО, азидом натрия) все комплексы
дыхательной цепи, включая цитохромоксидазу (место действия ингибитора), будут в
восстановленном состоянии, т.к. ингибитор препятствует транспорту электронов на
конечный акцептор – кислород.
45. См. вопрос 42.
46. При блокаде цепи
антимицином А блокируется окисление цитохрома b, поэтому ФМН, КоQ, цит b будут восстановленными, цит с1, с, а и а3 будут
окисленными.
47. СО ингибирует
цитохромоксидазу дыхательной цепи и препятствует переносу электронов на
конечный акцептор – кислород. Также угарный газ связывается с гемоглобином
эритроцитов, образуя устойчивое соединение – карбоксигемоглобин. При этом из-за
высокого сродства к СО гемоглобин теряет способность связывать кислород и
дыхательная цепь, работающая только при наличие O2,
перестает функционировать.